招募公告
【臨床試驗招募】國家藥品監督管理局批準注冊臨床試驗——BC008-1A注射液(PD-1/TIGIT雙特異性抗體)治療復發CNS WHO 4級腦膠質瘤
PART.1 研究概況
膠質母細胞瘤是惡性程度最高、具有高度免疫抑制性的腦膠質瘤,常規免疫療法響應率低,復發膠質母細胞瘤尚無標準治療方法。
雙特異性抗體免疫療法是目前世界上最前沿的惡性腫瘤療法之一,該療法通過協同阻斷腫瘤免疫抑制信號PD-1/TIGIT,高效激活免疫細胞殺傷功能,抑制腫瘤生長。本研究采用的BC008-1A注射液(重組抗PD-1/TIGIT人源化雙特異性抗體注射液)在前期研究中顯示出良好的治療效果和安全性,現已獲國家藥監局批準(批件號2024LP01506),在復發CNS WHO 4級腦膠質瘤患者中開展I期注冊臨床試驗(NCT 06773481)。
本研究由首都醫科大學附屬北京天壇醫院神經外科江濤院士、張偉教授領銜,通過靜脈輸注方式多次給藥并全程由專業團隊監測病情變化,目的是評價BC008-IA注射液治療成人復發CNS WHO 4級腦膠質瘤患者的安全性和有效性。目前面向全國招募受試者,入組患者將獲得免費藥物治療,歡迎有意者咨詢。
PART.2 研究內容
1
研究設計
研究類型:Ib期臨床研究
研究設計:單中心、開放標簽、劑量擴展
隨機化分組:900mg 劑量組: 計劃10-20人
1200mg 劑量組:計劃10-20人
2
主要入選標準
1.自愿簽署知情同意書;
2.復發CNS WHO 4級腦膠質瘤:經手術切除腫瘤組織病理學證實的CNS WHO 4級腦膠質瘤,經標準治療(放射治療+替莫唑胺化療)后,經MRI診斷、并由RANO標準評價確認為疾病進展且無手術計劃的受試者;
3.年齡≥18周歲的男性或女性(65歲以下);
4.根據RANO標準評估,存在至少一處顱內可測量的腫瘤病灶;
5.血液,凝血,肝腎功能無嚴重異常。
6.育齡期女性受試者或伴侶為育齡期的男性受試者,需同意在試驗期間(簽署ICF至末次給藥后6個月內)采取有效避孕措施。
3
主要排除標準
1.既往曾暴露于任何抗TIGIT、PD-1、PD-L1或CTLA-4類藥物;
2.曾患有其他惡性腫瘤,當前需進行治療的患者(除外經充分治療的宮頸原位癌、皮膚基底細胞或鱗狀細胞癌)者;
3.有自身免疫病或有自身免疫性疾病史或相關癥狀者;
4.不能行常規MRI檢查的受試者;
5.在首次使用試驗藥物前28天內或藥物5個半衰期內接受過化療、放療、生物治療、內分泌治療、靶向治療、腫瘤電場治療、免疫治療等抗腫瘤治療。
6.病灶范圍累及腦干、脊髓及軟腦膜播散轉移者;
7.參與試驗前1個月內使用過皮質類固醇激素,并且每天使用高于3mg地塞米松或等效劑量的其他激素進行系統治療者;
8.在試驗藥物首次給藥之前4周內或在研究期間接受減毒活疫苗;
9.合并有活動性感染者和傳染性疾病。;
10.有未控制的高血壓(收縮壓≥160mmHg和/或舒張壓≥100mmHg)、不穩定心絞痛、心律失常;以及嚴重心臟病,心功能分級(NYHA)為III級或IV級。
11.心功能分級(NYHA)為III級或IV級;
12.對試驗藥物的過敏;
13.既往有明確的神經或精神障礙史,如癡呆,依從性差者;
14.研究者認為不適合參加該研究的其他情況。
4.研究流程
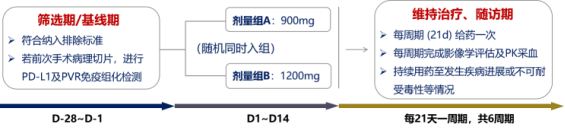
5
免費項目
試驗藥物:BC008-1A注射液藥物免費提供
實驗檢查:病毒學檢查,妊娠檢查(僅針對育齡期女性進行);血常規、尿常規、血生化、凝血功能、腦鈉肽(BNP)、心肌酶;甲狀腺功能檢查;促腎上腺皮質激素(ACTH);12-導聯心電圖;心臟彩超;頭顱MRI(平掃+增強)檢查。
6
受益分析
參加本研究,患者可能獲得總體生存期延長、無進展生存期延長和生活質量提高。但是不保證一定能從治療中受益,患者也可能由于治療無效或其他潛在疾病而出現病情惡化。患者將通過本項研究更加明確自身疾病情況,以便進行個性化治療和各項護理與支持。
PART.3 聯系方式
江濤院士團隊腦膠質瘤前沿創新診療門診(CURE):每周二上午
張偉教授專家門診:每周三上午;
特需門診:周四上午
聯系人:單俠醫生
聯系電話:17610156892
聯系人:王地醫生
聯系電話:15652020362
聯系地址:北京市豐臺區南四環西路119號,首都醫科大學附屬北京天壇醫院腫瘤5病區(住院二部十層)。
專家簡介

江濤:中國工程院院士,中國醫學科學院學術咨詢委員會學部委員
北京市神經外科研究所所長、首都醫科大學附屬北京天壇醫院神經外科學中心主任
主要從事腦膠質瘤臨床診治及研究工作。團隊創建患者多語種語言功能保護術式,改寫國際指南;牽頭制定中國腦膠質瘤分子病理分型、國家腦膠質瘤診療指南(2022年版)等多部國內外指南;發現首個腦膠質瘤精準治療靶點,研發靶向小分子藥物進入臨床試驗,成果發表于Cell,獲評2018年度“中國生命科學十大進展”,自主研發腦膠質瘤靶向新藥伯瑞替尼在國內正式上市。

張偉,主任醫師、教授、博士生導師
首都醫科大學附屬北京天壇醫院神經外科學中心副主任、神經腫瘤外科5病區主任,北京腦重大疾病研究院腦腫瘤研究所所長,首都醫科大學腦膠質瘤臨床診療與研究中心副主任。
主要從事腦膠質瘤的微創手術和創新療法研發。主筆制定國家衛健委《腦膠質瘤診療指南2022版》、《腦膠質瘤診療規范2018版》、亞洲腦膠質瘤國際指南等臨床指南與專家共識12部,主筆完成《腦膠質瘤醫療質量控制指標2024版》,作為編寫組組長制定《中國腦膠質瘤臨床管理指南2022》;以主要完成人獲國家科技進步二等獎1項,教育部科技進步一等獎2項,獲第76屆德國紐倫堡國際發明專利展大會金獎及最高獎,國際發明者協會聯合會(IFIA)最佳發明獎。










































 京公網安備111010602104056
京公網安備111010602104056