醫院動態
北京天壇醫院團隊首次揭示膠質母細胞瘤放化療抵抗機制 有望發現新靶向藥造福患者
腦膠質瘤,特別是其中惡性程度最高的膠質母細胞瘤對放化療不敏感,始終是膠質瘤治療中面臨的巨大難題。首都醫科大學附屬北京天壇醫院神經外科學中心江濤院士/張偉教授團隊日前首次發現膠質瘤干細胞重要標志物ALDH1A3表達陽性的膠質母細胞瘤放化療抵抗的機制,并發現一種能夠影響這種機制,增強膠質母細胞瘤對放化療敏感性的小分子抑制劑。
這一成果8月6日發表在國際生物學頂尖雜志《細胞》(Cell)的姊妹刊《細胞代謝》(Cell Metabolism)上。

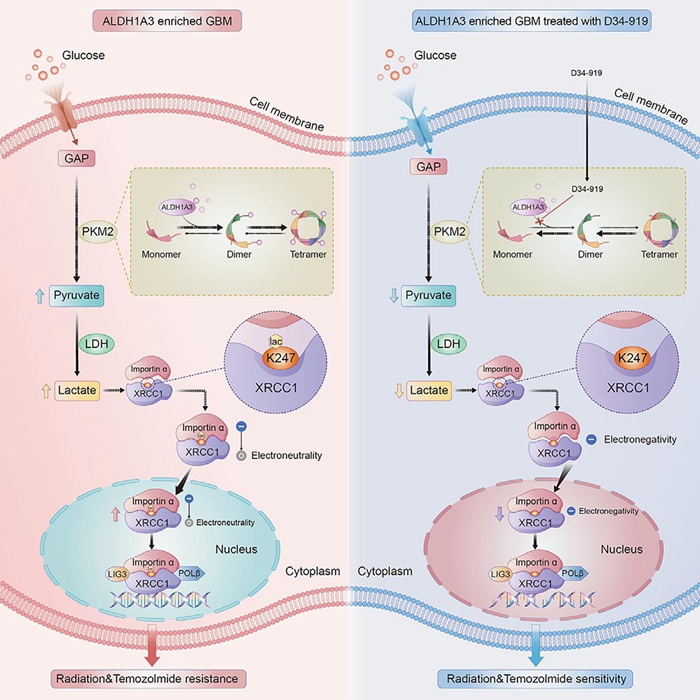
研發團隊負責人、北京天壇醫院神經外科學中心副主任張偉介紹,Warburg效應,即在氧氣充足的條件下,糖酵解通路異常激活是膠質母細胞瘤的重要代謝特征,然而該效應如何影響膠質母細胞瘤的臨床治療以及該過程的分子調控機制尚不明確。研究團隊基于中國人群腦膠質瘤基因組圖譜(CGGA)數據庫證實,膠質瘤干細胞重要標志物ALDH1A3表達陽性是導致膠質母細胞瘤對常規放化療均不敏感的重要原因,并通過膠質瘤干細胞數據庫及代謝組學分析,首次證實ALDH1A3通過與糖酵解限速酶PKM2互作,激活糖酵解通路并介導腫瘤細胞內乳酸堆積的分子機制。這一發現闡明了膠質母細胞瘤Warburg效應的調控機制,并且證實ALDH1A3通過異常激活糖酵解通路介導膠質母細胞瘤的放化療抵抗。
團隊進一步研究發現,ALDH1A3介導的腫瘤細胞內乳酸堆積,主要通過DNA損傷修復相關蛋白XRCC1 K247位點的乳酰化修飾,促進膠質母細胞瘤的DNA損傷修復功能,最終導致膠質母細胞瘤對放化療的抵抗。研究團隊研發了XRCC1 K247位點乳酰化修飾的兔源特異性抗體,可以作為臨床檢測工具,用于檢測臨床樣本中XRCC1的乳酰化修飾水平。
根據研究成果,江濤院士/張偉教授團隊通過小分子化合物高通量篩選平臺,成功篩選出靶向PKM2激活位點的小分子抑制劑——D34-919,并利用膠質瘤干細胞系、小鼠原位成瘤模型以及膠質瘤類器官模型證實D34-919小分子藥物可以有效阻斷ALDH1A3與PKM2互作,降低腫瘤細胞內乳酸濃度及XRCC1乳酰化修飾水平,從而抑制DNA修復功能,提高膠質母細胞瘤對放化療的敏感性。在動物模型中,該藥物還表現出較高的血腦屏障通過率及良好的安全性,已申報國家發明專利4項,PCT專利1項。
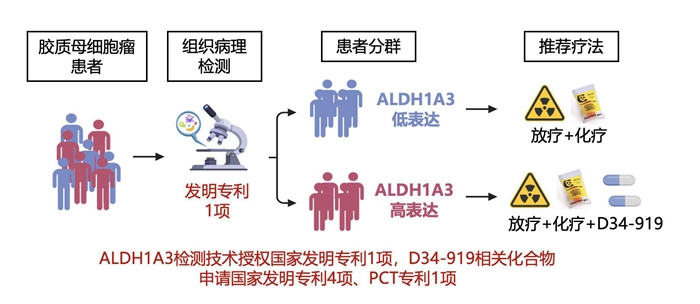
張偉表示,這一成果在提高膠質母細胞瘤對DNA損傷誘導療法的敏感性方面具有令人期待的潛力,有望轉化成為膠質母細胞瘤患者全新靶向藥物,為ALDH1A3表達陽性的患者找到新的治療道路。
這篇題為“Glycometabolic reprogramming-mediated XRCC1 lactylation confers therapeutic resistance in high ALDH1A3-expressing glioblastomas”的研究論文由首都醫科大學附屬北京天壇醫院主治醫師李冠璋與博士研究生王地為共同第一作者,首都醫科大學附屬北京天壇醫院神經外科學中心江濤院士與張偉教授(末位通訊)為共同通訊作者。
該研究得到了國家自然科學基金(82192894、82072768、82202896),內地與香港聯合資助計劃(2019YFE0109400),以及青年北京學者計劃、北京高校卓越青年科學家計劃和北京市醫管中心“登峰”人才計劃的支持。
聲音:
國際腫瘤代謝領域著名學者,浙江大學轉化醫學研究院呂志民教授在Cell Metabolism同期發表專題評論文章“Lactylation: Linking the Warburg effect to DNA damage repair”,對這一重大發現做出重要總結與評述:本研究揭示了非糖酵解酶ALDH1A3與PKM2的相互作用增強糖酵解和乳酸生成的機制,并展示了Warburg效應通過乳酸介導的蛋白乳酰化調控DNA損傷修復的全新發現,干預這一過程在提高膠質母細胞瘤對DNA損傷誘導療法的敏感性方面具有令人期待的潛力。
我國自主研發的抗腫瘤靶向藥雖取得不少成果,但與發達國家相比還有不小差距。2015—2019年,我國的全球首發上市新藥數量在12個主要對標國家中位列全球第三,占比6.0%,但排在首位的美國占比高達67.6%。因此,在保障質量的前提下,我國應大力提升原研抗腫瘤靶向藥的數量,為逐年增加的腫瘤患者提供更多優秀選項,在全球醫藥市場謀得更高份額和話語權。其中,小分子靶向藥具有安全性高、效果明確、對患者無侵入性傷害等優點,研究人員可以重點關注該領域。相信通過不斷努力,未來我國極有可能在生物制藥賽道上實現“彎道超車”。
作者介紹:

李冠璋
主治醫師,醫學博士,全國創新創業優秀博士后,天壇臨床科學家,“神經系統腫瘤靶向藥物與細胞治療北京市工程研究中心”免疫療法研發平臺負責人。長期從事腦膠質瘤治療抵抗機制探索與創新療法研發。主持國家級課題2項,北京市杰出青年項目1項,參與國家自然科學基金4項、中德合作交流項目1項。以第一及通訊作者(含共同)在國際知名學術期刊Cell Metabolism、Brain、Genome Medicine等發表SCI收錄論文28篇,中科院1區9篇,中科院2區11篇。發表論文總被引3088次,H指數27。參編專著3部,參與制定腦膠質瘤國際指南1部、國家指南3部。獲國家發明專利9項、實用新型專利1項、軟件著作權1項、PCT專利4項,其中4項國家發明專利經中國技術交易所公示后轉化。學術成果入選北京市優秀博士學位論文、全國博士后雙創賽銀獎、2022年度中國神經外科領域高價值論文等獎勵,個人先后榮獲北京市科協青年人才托舉工程、Wiley中國開放科學2022年度作者、北京天壇醫院優秀共產黨員等榮譽。

主任醫師,教授,博士生導師,博士后合作導師;青年北京學者,北京高校卓越青年科學家。首都醫科大學附屬北京天壇醫院神經外科學中心副主任、神經腫瘤外科五病區主任,北京腦重大疾病研究院腦腫瘤研究所所長,首都醫科大學腦膠質瘤臨床診療與研究中心副主任,神經系統腫瘤靶向藥物與細胞治療北京市工程研究中心首席技術官。主要研究方向為腦膠質瘤微環境調控機制與創新免疫療法研發,承擔國家自然科學基金及省部級科研項目20余項,以通訊作者在國際知名期刊Cell Metabolism, Brain, STTT(封面文章), PNAS, JNCI, EBioMedicine, Neuro-Oncology等發表SCI收錄論文55篇,總IF 392,H指數 36,被Nature Review Neurology等引用1641次,入選Wiley中國開放科學2022年度作者。主編/副主編中文專著5部,參編專著10部,參譯專著2部;授權國家發明專利11項、美國專利和歐洲專利公開各4項,其中4項實現轉化。主筆腦膠質瘤國際指南1部,英文指南2部,中國指南4部;以主要完成人獲國家科技進步二等獎、教育部科技進步一等獎等科技獎勵6項。先后入選北京市科技新星、青年拔尖人才、百千萬人才工程、北京市新國門領軍人才、北京市“登峰”人才計劃團隊負責人、第三屆“國之名醫-青年新銳”等。

中國工程院院士,中國醫學科學院學術咨詢委員會學部委員。現任首都醫科大學附屬北京天壇醫院神經外科學中心主任、北京市神經外科研究所所長、國家神經疾病醫學中心副主任,主任醫師、教授、博士研究生導師。長期從事腦腫瘤的基礎及臨床研究,是我國神經功能保護手術理念的率先實踐者與手術策略的主要創建者,神經外科領域學科帶頭人。主持國家重點研發計劃、國家自然科學基金重大項目和科技部重大專項。建立了中國/亞洲腦膠質瘤基因組學數據平臺(CGGA/ AGGA),CGGA數據庫獲2021年“中國生物信息學十大進展”。揭示了腦膠質瘤惡性進展關鍵機制,自主研發了腦腫瘤1.1類靶向藥物,成果發表于Cell。以通訊作者在Cell等國際期刊發表研究論著300余篇;以第一完成人獲國家科技進步二等獎1項、省部級一等獎2項,成果入選2018年度“中國生命科學十大進展”。榮獲第十四屆光華工程科技獎、北京市衛生系統優秀共產黨員、北京市先進工作者,入選北京學者、北京市“高創計劃”領軍人才等。
(研究團隊)










































 京公網安備111010602104056
京公網安備111010602104056